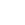2024年5月1日,由中国医药质量管理协会发布的《研究者发起的抗肿瘤体细胞临床研究细胞制剂制备和质量控制规范》(T/CQAP 3014—2024)标准(以下简称“标准”)将正式实施。

该标准旨在制定适应中国国情、符合企业实际、标准统一规范的抗肿瘤体细胞临床研究质量控制体系。
该标准由22位行业专家共同起草,共涉及17家单位。
中山大学肿瘤防治中心主任导师兼中国医药质量管理协会细胞治疗质量控制与研究专业委员会主任委员夏建川、实验研究部副研究员向橦、广东省药品检验所一级主任科员蒋玉辉、广东天科雅生物医药科技有限公司等参与起草,助力推动中国抗肿瘤体细胞临床研究。
标准的主要技术内容规定了在研究者发起的抗肿瘤体细胞临床研究中细胞制剂的分类,细胞制剂制备,细胞制剂质量控制要求,细胞制剂的临床前研究,细胞制剂的放行质量控制要求、标签、包装、运输、贮存及不合格和剩余细胞制剂的处理。
2023年10月27日,天科雅生物参与了由中国医药质量管理协会组织、中山大学肿瘤防治中心牵头发起的《研究者发起的抗肿瘤体细胞临床研究细胞制剂制备和质量控制规范》团体标准审查会暨“中国医药质量管理协会抗肿瘤药物与细胞药物临床研究”调研会,并就本行业未来发展提出意见和建议,推动体细胞质量控制规范和标准建立。
作为国内细胞行业的重要推动者,天科雅生物专注于肿瘤免疫细胞治疗技术的创新性研发和产业化,未来也将会进一步助推中国细胞治疗临床研究相关工作的规范化、标准化、科学化及中国细胞治疗相关技术高质量发展。


 中文
中文
 中文
中文








 0
0