2021年8月14日/医麦客新闻 eMedClub PR News/--在CAR-T疗法的领域中,对于血液肿瘤效果最为显著,CAR-T疗法在治疗难治复发性B细胞急性淋巴细胞白血病时可以达到约90%完全缓解率,而在治疗B细胞淋巴瘤时可以达到约70%完全缓解率。
除此之外,部分临床显示,大约有20%的患者接受CAR-T治疗后可以获得长期生存,CAR-T疗法对于血液肿瘤展现出令人惊叹疗效。
根据2020年数据显示,中国癌症死亡人数中前10的癌症中,死亡数达到83%,仅有一项是血液肿瘤,其他九项都是实体瘤。
事实上,CAR-T在探索治疗实体瘤的路上一直没有停歇。不少研究机构都尝试过CAR-T细胞疗法应用于实体瘤。但实体瘤分子复杂性的增加和良好抗原靶点的缺乏成为CAR-T细胞疗法开发的巨大障碍。
近日,The Lancet Oncology杂志发表了一篇题为《CAR-T-cell therapy for solid tumours》的社论,对CAR-T细胞疗法用于实体瘤的挑战及前景进行了阐述。
2021年6月2日,细胞疗法公司Tmunity Therapeutics一直在开发前列腺特异性抗原(PSMA)导向的、TGF-β不敏感的CAR-T细胞。前列腺癌细胞分泌TGF-β作为免疫抑制因子,因此研究人员假设使用PSMA导向的CAR-T细胞与显性失活TGF-β受体共表达将增强前列腺癌患者的抗肿瘤免疫力。
针对实体瘤前列腺特异性膜抗原(PSMA)开发的一款CAR-T细胞疗法惨遭挫折。起初,该疗法在CART-PSMA-TGFβRDN试验显示出乎意料的惊人疗效,受试者的前列腺特异性抗原(PSA)大幅下降。
根据报道,在接受CAR-T细胞治疗的各种血液癌症患者中,多达一半的患者出现免疫效应细胞相关神经毒性综合征(ICANS)以及细胞因子释放综合征(CRS)。尽管研究人员给予了及时治疗,但是严重患者的处理仍十分棘手,最终还是有两名患者死亡。
一直以来,科学家也尝试通过多种途径来解决CAR-T疗法在实体瘤中出现问题,如之前的免疫肿瘤学公司Imugene Limited,通过CD19的溶瘤病毒CF33-CD19与CD9 CAR-T的联合疗法,利用溶瘤病毒增强CAR-T的靶向性将其递送至实体瘤,进一步增强了CAR-T细胞治疗的疗效。
尽管如此,实体瘤CAR-T细胞疗法的发展依然面临着诸多挑战,其中最困难的是理想靶抗原的鉴定。值得注意的是,许多实体瘤相关的抗原也在健康组织上表达,从而增加了脱靶不良事件的风险。科学家指出CAR-T疗法靶向实体瘤之所以受到较多限制,主要是由于实体瘤的特殊免疫环境。
实体瘤的肿瘤微环境对
CAR-T造成了哪些阻碍?
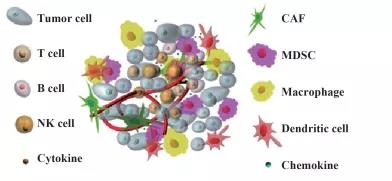
血液肿瘤和实体瘤最主要的区别就是实体瘤存在肿瘤微环境(TME)。
肿瘤微环境指的是肿瘤的发生、生长及转移与肿瘤细胞所处的内外环境有着密切联系,它不仅包括肿瘤所在组织的结构、功能和代谢,而且亦与肿瘤细胞自身的(核和胞质)内在环境有关。
▲ 肿瘤微环境(图片来源:网络)
TME的复杂环境往往利于肿瘤生长,而不利于包括CAR-T细胞在内的人体免疫细胞生存。目前,已知的对肿瘤微环境造成的障碍有:
1、血管障碍与基质障碍
在实体瘤的TME中,肿瘤血管是由肿瘤基质中的成纤维细胞(CAFs)和多种生长因子的调控而生成的。TME环境下的异常导管系统和正常血管结构不同,在这种环境下会导致T细胞存活率下降,功能衰竭,也会导致CAR-T细胞很难在肿瘤内部迁移。此外,TME的基质屏障由结缔组织形成,所以具有物理上阻碍CAR-T细胞进入并降低运输效率的作用。
2、免疫检查点
免疫检查点是维持自身耐受性和调节免疫反应信号通路的关键因子。通过干预与影响T细胞免疫应答发挥作用,保护机体免于自身免疫和炎症的伤害,当免疫检查点无法正常发挥功能时,会引发肿瘤耐受,使得肿瘤细胞逃逸免疫系统的追杀。
3、免疫抑制细胞及细胞因子
抑制细胞:
T细胞(Tregs)通过其抑制功能来防止由于过度或不必要的免疫激活而导致的自身免疫和组织损伤,在维持免疫稳态中具有重要作用。然而在肿瘤微环境中,Tregs细胞通过其高亲和力IL-2受体从周围摄取IL-2,使其无法用于反应性T细胞。
肿瘤相关的中性粒细胞在肿瘤的生长和进展中展现出双重性,TAN可通过释放ROS和中性粒细胞弹性蛋白酶来介导肿瘤细胞杀伤,通过释放ROS抑制肿瘤细胞转移,并在抑制TGF-β后增强抗肿瘤T细胞反应,TGF-β还能促进T细胞分化成Tregs,促进Tregs调节免疫功能导致肿瘤细胞逃逸。
细胞因子:
白介素10(IL-10),也被称为人类细胞因子合成抑制因子(CSIF),是一种抗炎细胞因子。人体中白介素10是由IL-10基因编码的,IL-10通过活化的巨噬细胞来抑制炎症因子。IL-10可以通过降低肿瘤微环境中的抗肿瘤免疫反应来促进肿瘤免疫逃逸,但也有研究发现,IL-10对肿瘤患者长期生存所必需的血管生成和转移有根除和抑制作用。
通过了解与肿瘤生长相关的细胞因子,或许有助于新型CAR-T细胞的设计,提高归巢能力。
4、靶点选择问题
在实体瘤中,最困难的挑战是理想靶抗原的鉴定。血液癌症通常表达单一的、特异性的、肿瘤相关抗原,所以能够有效实现对肿瘤的特异性杀伤,而实体瘤具有显著的抗原异质性、可转移性,因此筛选合适的表面特异性抗原存在难度,导致CAR-T细胞对实体瘤难以实现精准杀伤。
值得关注的是,大部分研究选用的肿瘤相关抗原在正常组织中也会少量表达,导致CAR-T细胞产生脱靶毒性。如果只用一种单靶点的CAR-T细胞治疗实体瘤,那么实体瘤高异质性的特点就决定了其必然会复发或无法根除。
实体瘤的挑战与思考
尽管CAR-T细胞治疗在实体瘤困难重重,但仍然值得期待。优化CAR-T或CAR-T细胞与现有治疗的联合,这两种方式均对提高CAR-T细胞治疗实体瘤带来希望。
此外,CAR-T疗法在实体瘤治疗领域存在巨大的临床需求,目前CAR-T细胞治疗实体瘤仍然充满未知。但大量科研工作者与药物研发专家正在积极探索,攻坚克难。虽然该领域研究还处于探索阶段,但随着研究的不断深入、相信未来将有更多实体瘤患者受益于CAR-T疗法。
参考资料:
1.https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00353-3/fulltext
2.佰傲谷BioValley《CAR-T在肿瘤微环境中面临哪些挑战?》
3.北京药监《实体瘤领域CAR-T疗法未来可期》
本文来源于:医麦客


 中文
中文
 中文
中文








 0
0