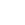以下文章来源于BiG生物创新社 ,作者BiG专栏
相较于免疫检查点抑制剂在实体瘤领域的突破,CAR-T目前只在血液肿瘤领域有所突破,患者人数占比更多的实体瘤领域,鲜有进展和突破。
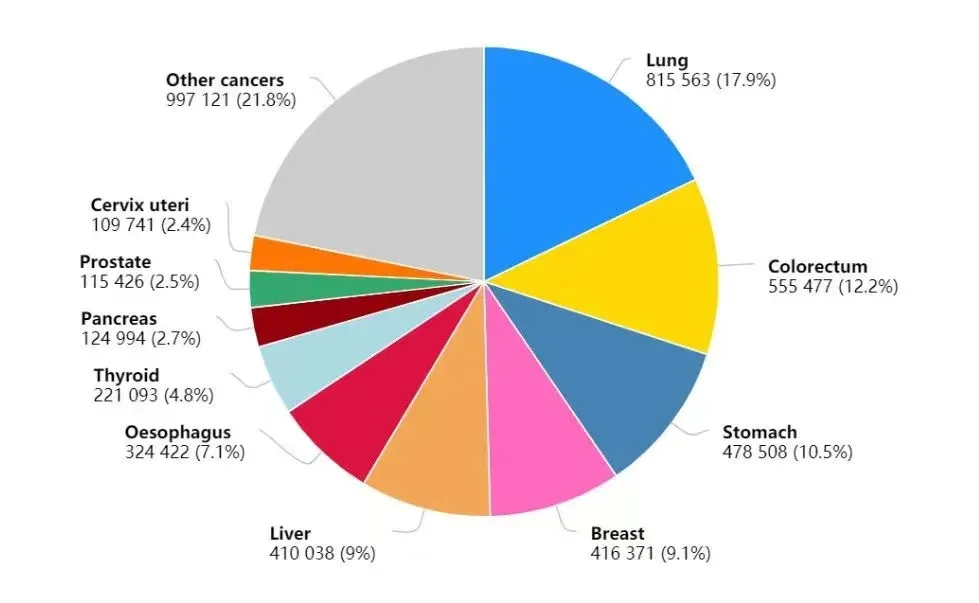
图1 2020年中国癌症新发病例数前十的癌症类型
令人期待的是,CAR-T疗法不仅开始尝试CAR-NK、CAR-NKT、CAR-Treg等其他类型免疫细胞的工程化改造。另外,由于受限于肿瘤抗原的异质性,单靶点CAR-T也逐步开始向多靶点CAR-T细胞疗法进行转变,并获得了不错的抗肿瘤治疗效果。本文将梳理近期有关多靶点CAR-T细胞疗法的进展,以飨读者。
01
首先, 让我们简单回顾下CAR-T疗法的作用机制, CAR(嵌合抗原受体)是一种基因工程技术制造的人工受体分子,它可以赋予免疫效应细胞(如T淋巴细胞)针对某个靶点抗原表位的特异性,从而增强T淋巴细胞识别抗原信号与活化的功能,继而回输淋巴细胞以实现抗肿瘤的作用。
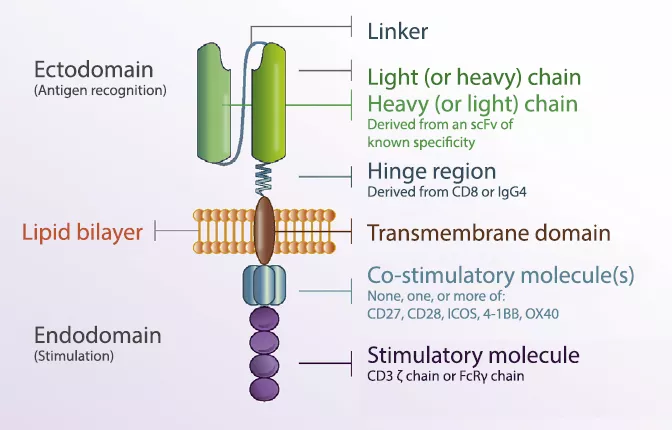
图2 CAR结构 [1]
而所谓的多靶点CAR-T细胞,主要是设计用于靶向不同的肿瘤抗原,包括具有两个CAR的双CAR-T细胞或具有多个单链抗体(scFv)的串联CAR-T细胞。这种多靶点CAR-T, 理论上能够克服肿瘤抗原异质性与肿瘤抗原逃逸
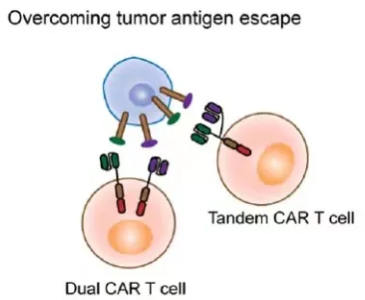
图3 多靶CAR-T, 克服肿瘤抗原逃逸 [2]
02 CD19/CD22 CAR-T
CAR-T在临床应用中同样存在耐药现象。
以B细胞急性淋巴细胞白血病(B-ALL)为例,接受CD19靶向CAR-T细胞治疗的患者中,多达25%的患者复发,表现为CD19阴性或低CD19。这种现象被称为抗原逃逸。主要原因就在于单靶点存在下调或丢失,治疗效果并非如预期所想,而如若设计可以靶向CD19和CD22的双重定向CAR-T,理论上能够有效解决单靶点耐药的弊端。这种设想在临床上已经得到了验证。
2021年10月12日,Nature Medicine期刊上公布了抗CD19和抗CD22 CAR的自体转导T细胞(AUTO3)在复发性或难治性B-ALL(n=15)的儿童和年轻成年患者中的I期试验,以评估AUTO3的疗效。
研究结果表明:AUTO3具有良好的安全性,没有剂量限制性毒性或AUTO3相关的严重细胞因子释放综合征或神经毒性病例报告。在治疗后1个月时,缓解率(即完全缓解或完全缓解但骨髓恢复不完全)为86%(15名患者中的13名)。1年总生存率和无事件生存率分别为60%和32%。
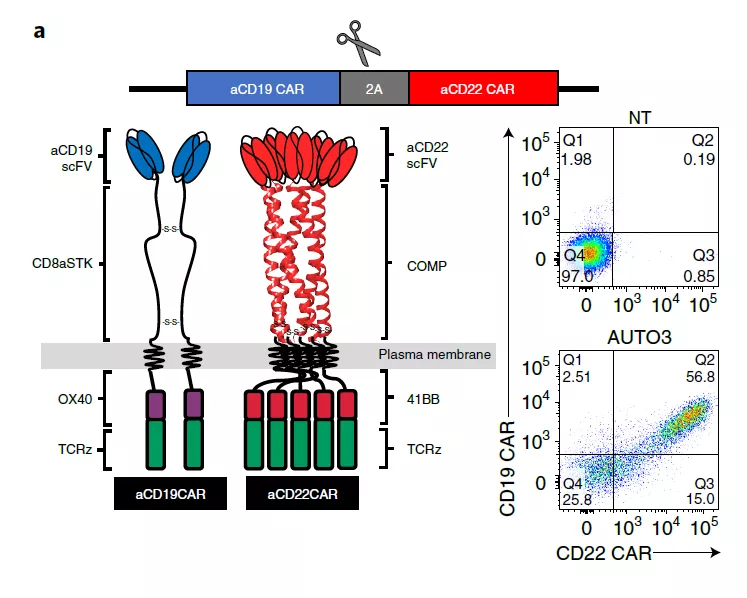
图4 AUTO3的结构与流式细胞结果 [3]
其实,早在2019年,AUTO3就获得了治疗ALL的孤儿药物资格。良好的疗效和前景来源于AUTO3是一种自体富集T细胞,经单个逆转录病毒载体修饰表达2个独立的嵌合抗原受体(CAR),分别靶向B淋巴细胞抗原CD19和CD22,并且每个CAR都针对单个靶点活性进行了独立优化。通过同时针对2种B细胞抗原,AUTO3旨在减少B细胞恶性肿瘤患者因单一抗原丢失导致的复发。
通过解决抗原逃逸(这类患者复发的一个常见原因),AUTO3有机会成为治疗儿科ALL的同类最佳疗法。与目前已上市销售的CAR-T疗法相比,AUTO3还可以提供更好的安全性,在临床研究中观察到低水平的严重细胞因子释放综合征(CRS)和神经毒性。
03 多靶向CAR-T与实体瘤
与单靶点抗原逃逸导致的耐药相比,由于物理屏障和/或免疫抑制肿瘤微环境(TME)所导致的耐药或者药物不响应问题则是临床上较为棘手的瓶颈。因此,CAR-T细胞成功治疗实体肿瘤至少需要确定合适的靶抗原,使CAR -T细胞能够进入肿瘤的所有部位,并克服肿瘤微环境(TME)的免疫抑制作用。
而在实体瘤中,最为棘手的应该是胶质母细胞瘤(GBM),由于肿瘤细胞异质性高和血脑屏障通透性低等特征,治疗药物鲜有进展。值得期待的是,2021年9月的一项来自美国北卡罗来纳大学教堂山分校的研究,结果令人兴奋。研究人员发现一种新开发的使用经过基因改造的T细胞来锁定和攻击癌细胞上的两种抗原的(CD28和4-1BB)CAR-T细胞免疫疗法,对植入人类神经母细胞瘤组织的小鼠非常有效。这种双重靶向限制了肿瘤的重新生长,并防止神经母细胞瘤细胞躲避这些攻击性的T细胞。
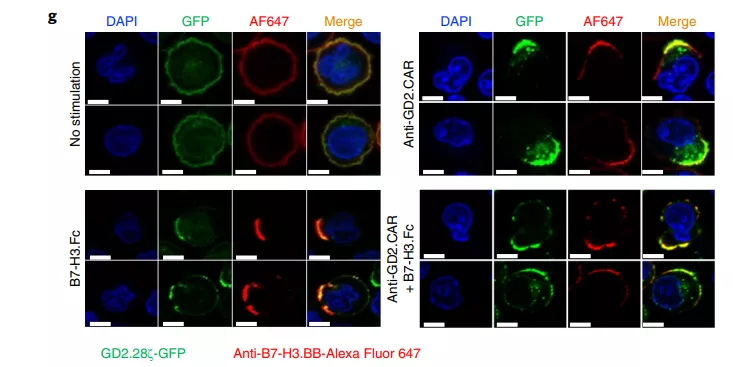
图5 共聚焦显微镜成像示意图 [4]
在共聚焦显微镜成像显示CARs在表达GFP标记的GD2.28ζ(绿色)和B7-H3.BB(红色)的T细胞中聚集,能够靶向神经母细胞瘤细胞,并观察杀伤效果。在随后植入了神经母细胞瘤的小鼠上,也验证了双靶向CAR-T细胞疗法的优异抗肿瘤结果。
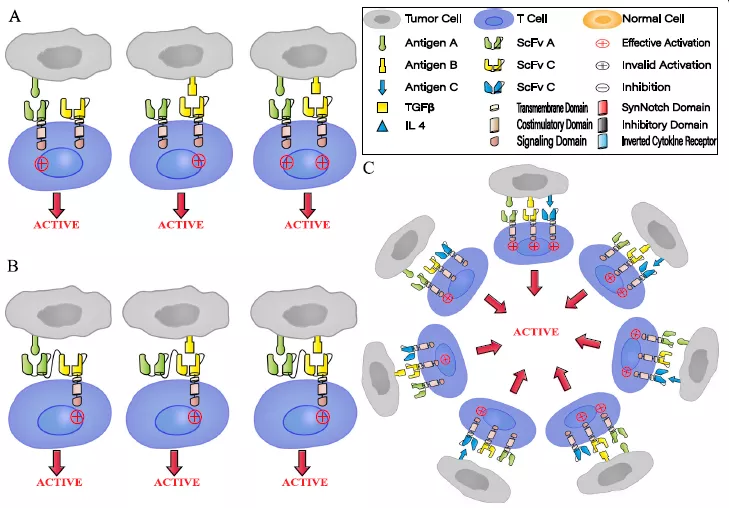
图6 三种多靶向CAR的设计策略 [5]
但我们也知道,人体的肿瘤微环境和异质性,要远高于小鼠。可能即使采用双靶向 CAR-T也无法覆盖足够的靶抗原。
因此,结合多个靶抗原的CAR-T细胞疗法才有可能在胶质母细胞瘤(GBM)上有所突破。有研究团队,针对GBM患者开发了三价的CAR-T细胞(同时靶向HER2、IL13Rα2和EphA2),最终癌细胞的清除率接近100%。Trivalent CAR之所以具有如此强大抗肿瘤活性,是由于可以覆盖多个靶抗原并具备三条信号转导通路可高强度激活T细胞,以及Trivalent CAR与靶抗原结合时形成的三价免疫突触提高了抗肿瘤活性。
总结
尽管多项研究数据显示,多靶向CAR-T治疗多种恶性肿瘤的疗效显示积极,成为预防抗原逃避的有效手段,但这种类型的CAR-T细胞可被多个靶抗原识别并高强度激活T细胞,容易引起细胞因子风暴,并对低表达靶抗原的正常细胞过度杀伤。
因此需要在结构设计和功能上进一步的优化,在确保安全的情况下有效发挥肿瘤杀伤作用。我们衷心期待CAR-T疗法能够实现实体瘤领域的新突破。
参考文献
[1]Gill, S., M.V.Maus, and D.L. Porter, Chimeric antigen receptor T cell therapy: 25years in the making. Blood Reviews, 2016. 30(3): p. 157-167.
[2] Abreu, T.R., et al., Current challenges and emerging opportunities of CAR-T cell therapies. Journal of Controlled Release, 2020. 319: p. 246-261.
[3] Nature Medicine | VOL 27 | Octob er2021 | 1797–1805 |.
[4] Koichi Hirabayashi et al. Nature Cancer, 2021, doi:10.1038/s43018-021-00244-2.
[5] Han X, Wang Y, Wei J, Han W. Multi-antigen-targeted chimeric antigen receptor T cells for cancer therapy. J Hematol Oncol. 2019;12(1):128.


 中文
中文
 中文
中文








 0
0