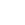近日(10月7日),Allogene Therapeutics透露,FDA暂停了该公司开发的同种异体CAR-T细胞疗法AlloCAR-T的临床研究。

公告显示,此次临床暂停的原因是Allogene向FDA通报了ALPHA2临床研究中出现一例患者“染色体异常”,该案例是在患者接受全血细胞减少骨髓活检时被查出。目前公司正在进行进一步调查以进一步确定观察到的异常,包括任何临床相关性,克隆扩增的证据或与基于编辑的潜在关联。
该案例患者为IV期转化滤泡性淋巴瘤伴c-myc基因重排,其肿瘤对之前接受过的两种免疫化疗和额外的放射性治疗无效。此外,该患者无法接受自体CD19 CAR-T细胞疗法的治疗,原因是其自体细胞增殖不充分导致CAR-T细胞制造失败。该患者在接受ALLO-501A治疗后遭遇了1级细胞因子释放综合征(CRS)和2级免疫效应细胞相关神经毒性综合征(ICANS),需要进行高剂量类固醇治疗。随后,该患者出现了全血细胞减少,活检显示再生障碍性贫血,并且出现了染色体异常的ALLO-501A CAR-T细胞。早期数据显示,CAR-T细胞扩张在第28天达到峰值,此后有所收缩。患者对ALLO-501A有着部分应答,并且随后进行了异体干细胞移植。有研究报道,自体CAR-T细胞疗法的血细胞减少需要挽救性干细胞移植。目前,Allogene已经给100多名患者使用了其经过基因编辑的AlloCAR T产品。公司认为,ALPHA研究的数据支持ALLO-510A在大B细胞淋巴瘤患者中的良好临床表现。
Allogene Therapeutics
Allogene Therapeutics是一家专注于“即用型(off-the-shelf)”CAR-T疗法研发的公司。该公司研发的AlloCAR TTM使用的是来自于健康捐赠者的T细胞。
利用来自于Notch的专有iPSCs平台进行成熟T细胞和CAR-T工程细胞的生产。

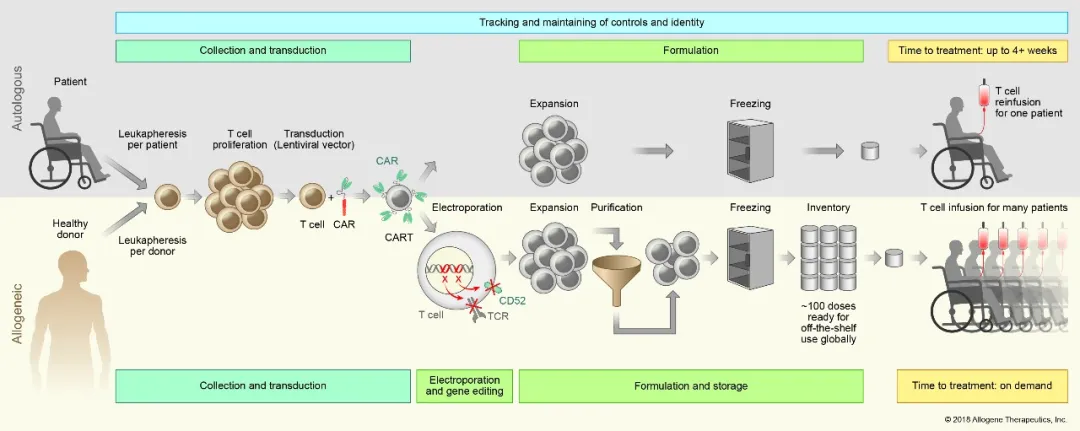
为了减少或杜绝移植物抗宿主病(GVHD)和异基因排斥风险,Allogene会对CAR-T细胞进行基因编辑,敲除T细胞受体基因。此外,Allogene还开发了一款抗CD52单抗ALLO-647用于抑制宿主免疫系统,以支持AlloCAR TTM的持续治疗,达到充分疗效。
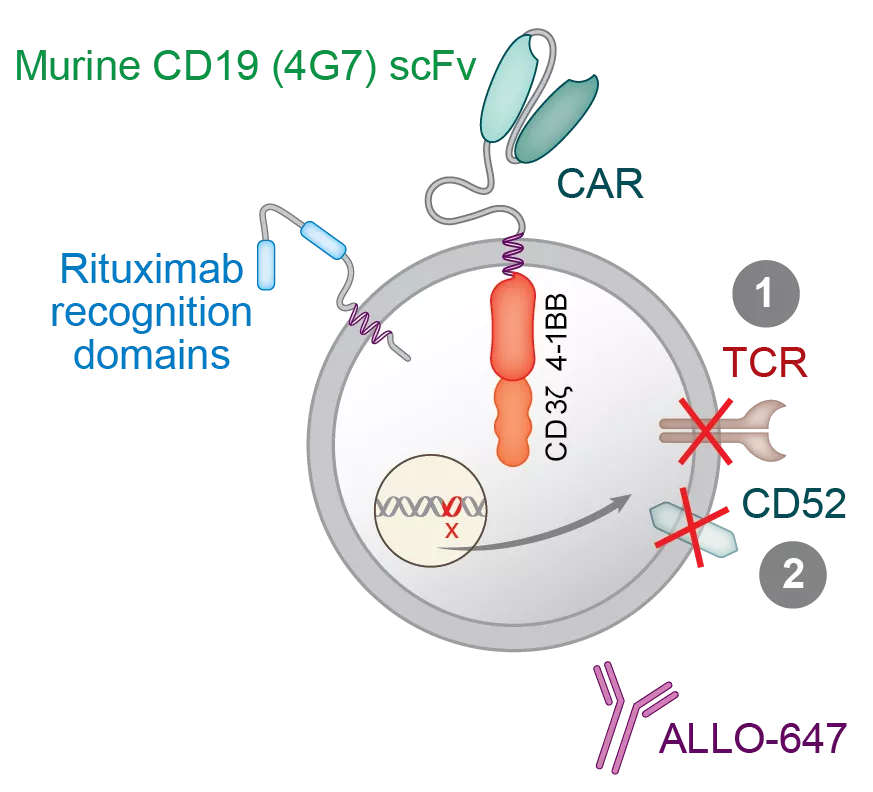
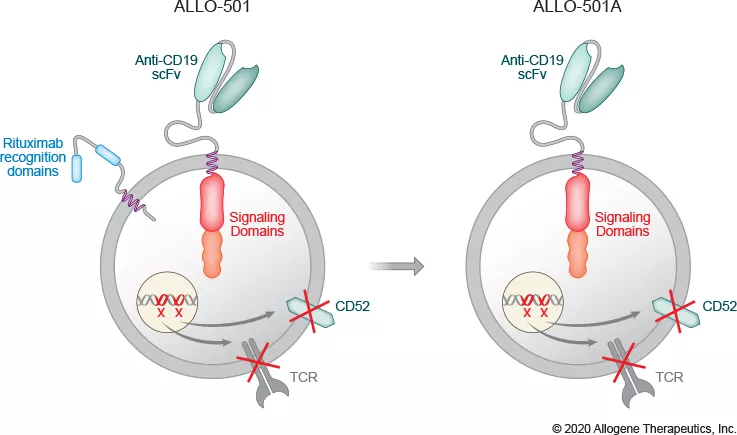
ALLO-501A是基于AlloCAR TTM的首批在研产品之一。该疗法为抗CD-19 AlloCAR TTM。2020年6月,ALLO-501A开始了ALPHAI/II期临床。
ALLO-501A是ALLO-501的进化产品,其区别在于消除了ALLO-501中利妥昔单抗识别域。
其他相关
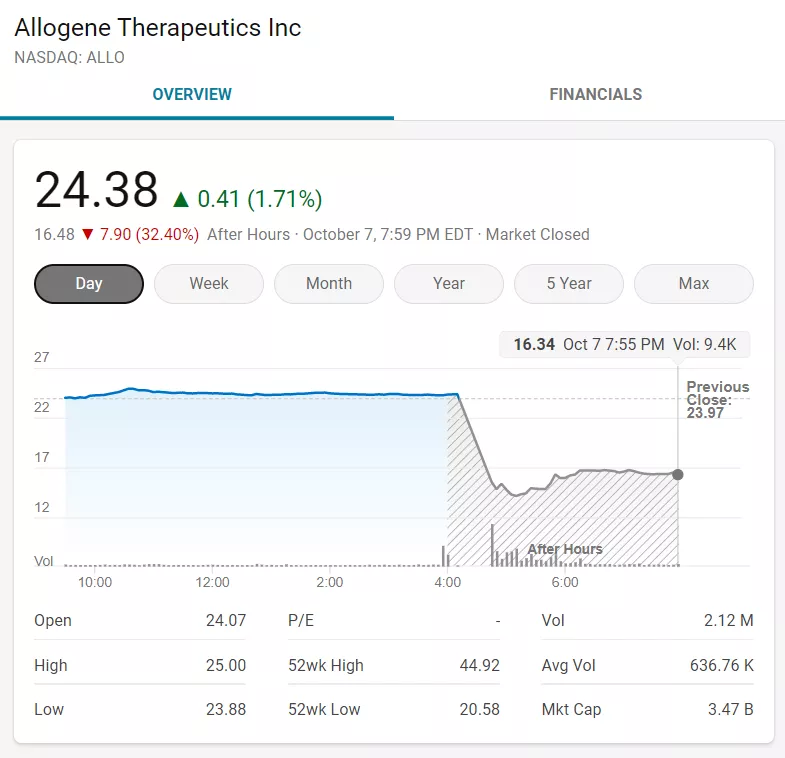
受此利空影响,Allogene盘后暴跌超30%,市值蒸发10亿美元。
事实上,对于染色体异常,Allogene CEO David Chang表示公司团队已经有了一些想法:“首先,基因核酸酶的使用“可能导致染色体改变,这在临床前研究中曾被观察到。此外,任何人体内的T细胞在快速扩增的过程中都可能发生突变和染色体变化……。”Allogene Therapeutics的创始团队为Kite 创始人Arie Belldegrun和原Kite 研发执行副总裁兼首席医学官David Chang,2017年吉利德斥资120亿美元收购Kite Pharma,此后将CAR-T疗法顺利推向市场。收购发生半年后,Arie Belldegrun与David Chang成立Allogene Therapeutics进行通用CAR-T疗法的研发。2020年12月,Allogene与瓴路药业(Overland)宣布成立合资公司Allogene Overland Biopharm。合资公司专注于在大中华区、台湾、韩国和新加坡开发、制造和商业化AlloCAR T疗法。合资公司拥有在许可区域内开发、制造和商业化针对BCMA、CD70、FLT3和DLL3的特定异基因候选产品的独家许可。瓴路药业将投资1.17亿美元的资本金,其中包括向Allogene预付的4000万美元和用于支持合资企业运营的7700万美元资本金。
参考来源:https://ir.allogene.com/news-releases/news-release-details/allogene-therapeutics-reports-fda-clinical-hold-allocar-t-trials


 中文
中文
 中文
中文








 0
0